芳香環に置換基を導入する方法として、ハロゲン化、スルホン化、ニトロ化、Friedel-Crafts反応といった芳香族求電子置換反応があります。
この芳香族求電子置換反応では、芳香環に対する求電子剤の付加により反応が進みますが、芳香環に何か置換基がついていると、芳香環の電子密度が変化するため反応性が変化します。
実践的な合成化学では、ほとんどの場合、芳香環に1つや複数の置換基がついているため、置換基により反応性がどう変わるのか、次の置換基がどこに入るのか(=配向性)を理解していることがとても重要なのです。
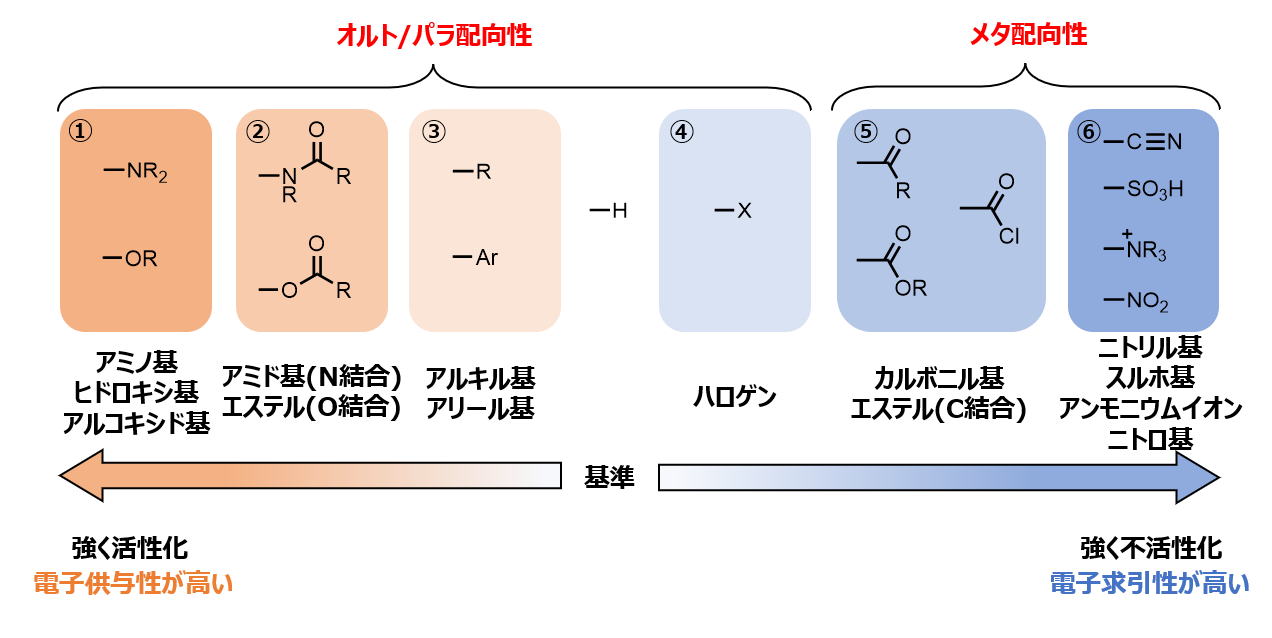
活性化/不活性化官能基と配向性
そもそも芳香環を活性化するとは、芳香族求電子置換反応の反応性を上げる、すなわち芳香環の電子密度を上げることを言います。逆に、不活性化とは芳香環の電子密度を下げることを言います。
したがって、置換基が芳香環を活性化するのか、不活性化するのかを理解するということは、その置換基が電子供与性なのか、電子求引性なのかを理解することに帰着します。
活性化/不活性化置換基と配向性をまとめると、以下のようになります。
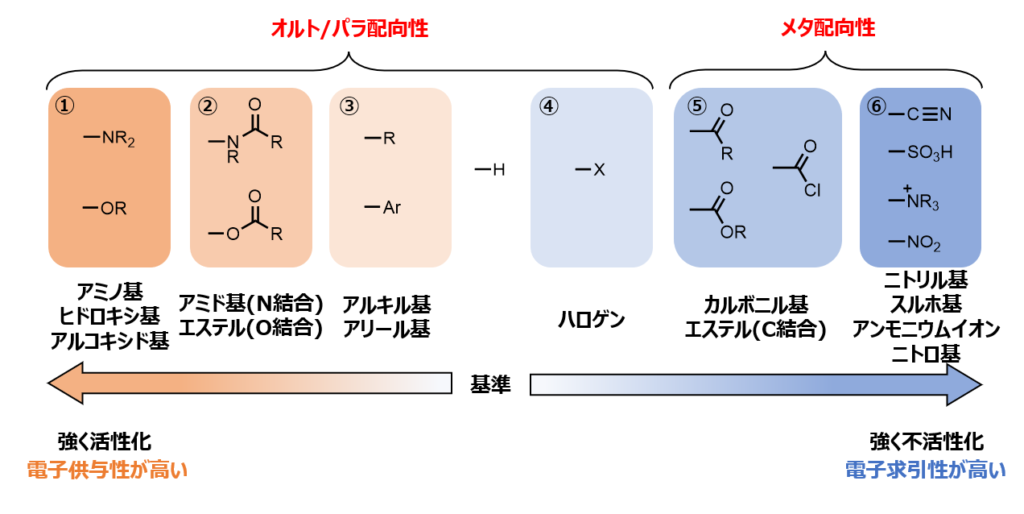
グループの特徴
電子供与性置換基
・①のグループ(アミノ基、ヒドロキシ基、アルコキシド基)・・・強活性化
このグループの置換基は最も電子供与性が高く、最も強く芳香環を活性化することができます。
なかでも、-NR2は-ORよりも電子供与性が高いです。また、-NR2の中でも1級アミン-NH2が最も電子供与性が高く、-OHは-ORよりも電子供与性が高いです。
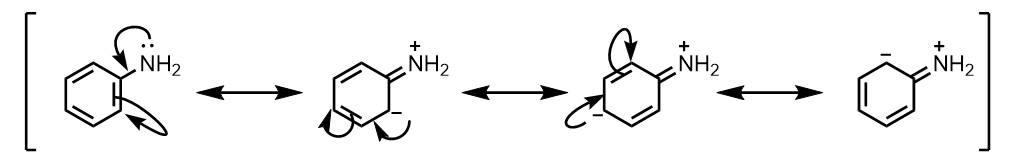
このグループの共通点は、N, Oなどの非共有電子対を持った原子で芳香環と結合している点です。
非共有電子対を供与することで、以下のように、芳香環に負電荷をもつ共鳴寄与体を書くことができます。
・②のグループ(アミド基(Nで結合)、エステル(Oで結合))・・・中活性化
このグループの置換基は、①と同様にN, Oなどの非共有電子対を持った原子で芳香環と結合していて、中程度の電子供与性を持ちます。
①と違う点は、N, Oのとなりに、C=Oが結合している点です。C=Oは電子求引基であるため、①よりかは電子供与性が落ちます。
C=Oが電子求引性というのは必ず知っておきましょう。=Oの部分をスポイトに見立てて、電子をチューチュー吸い取ると覚えておきましょう。
・③のグループ(アルキル基、アリール基、ビニル基 etc.)・・・弱活性化
アルキル基、アリール基、ビニル基など、炭化水素基は少しの電子供与性を持ち、ちょっとだけ芳香環を活性化します。
アルキル鎖は、超共役により電子供与性をもちます。アリール基やビニル基などの不飽和炭化水素は、共鳴により供与/求引どちらもできますが、供与性の方が少しだけ大きいようです。
電子求引性置換基
・④のグループ(ハロゲン)・・・弱不活性化
F, Cl, Br, Iのハロゲンは、弱い電子求引性の置換基で、芳香環を少し不活性化します。
非共有電子対を持っているため、共鳴により芳香環に電子を供与することもできますが、電子求引性の方が強く作用することがわかっています。
・⑤のグループ(カルボニル、エステル(Cで結合))・・・中不活性化
前に述べたように、カルボニル基C=Oは電子求引性の基であるため、これが直接芳香環に結合していると、芳香環は不活性化されます。
・⑥のグループ(ニトリル基、スルホ基、正電荷保有の置換基、ニトロ基)・・・強不活性化
これらの置換基は、芳香環から強く電子を求引して、強く不活性化します。
正電荷を持っている-+NH3などの基は言うまでもなく、正電荷を中和しようと芳香環から電子を求引します。
また、S=Oを2つもつ-SO3Hや三重結合の-C≡N、共鳴構造のかける-NO2は強く電子を求引します。
このように、芳香環に結合している原子に、ヘテロ原子が多重結合している場合(C=O以外で)は強く電子を求引すると覚えましょう。
配向性の覚え方
配向性を覚えるために、活性化/不活性化置換基を覚えているとすぐ覚えられます。
オルト/パラ配向性とメタ配向性の置換基は、次のように分けられます。
オルト/パラ配向性・・・活性化置換基&ハロゲン
メタ配向性・・・ハロゲンを除く、不活性化置換基
ハロゲンが例外だということだけ覚えておきましょう。
配向性の理由
オルト/パラ配向性の置換基はオルト位/パラ位に次の置換基が付加すると、メタ位よりも多くの共鳴寄与体がかけて、また、安定な構造が存在するためです。
たとえばアニリンに対して求電子剤(E+)が付加する場合を考えてみましょう。
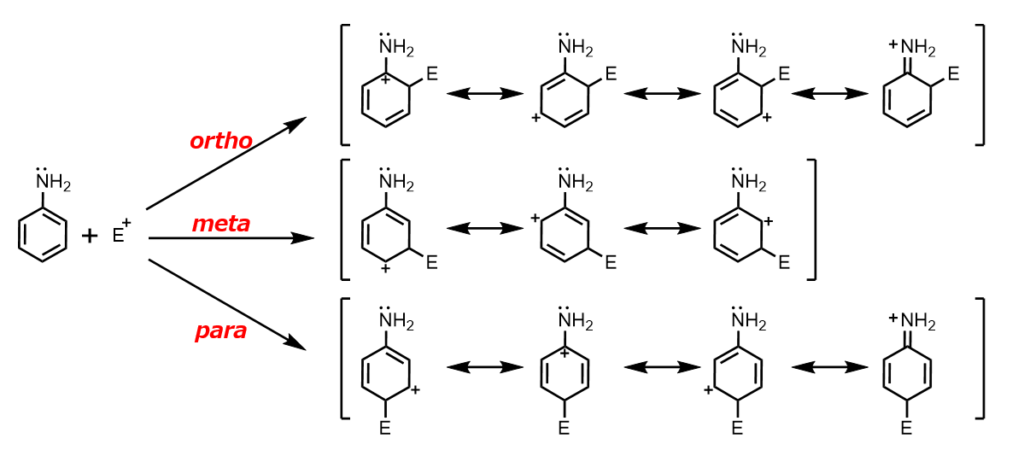
オルト位とパラ位では共鳴寄与体が4つかけます。さらに、オルト位とパラ位の一番右のN上に正電荷がある構造は、すべての原子についてオクテット則を満たすために安定な構造となります。
ハロゲンの場合も同様です。
また、非共有電子対をもたないアルキル基もオルト位パラ位に付加するときだけ安定な3級のカルボカチオンが生成するため、オルト/パラ配向性となります。
メタ配向性の場合は、オルト/パラ位に付加したときに相対的に不安定になるために発現します。
たとえばニトロベンゼンに対して求電子剤が付加する場合を見てみましょう。
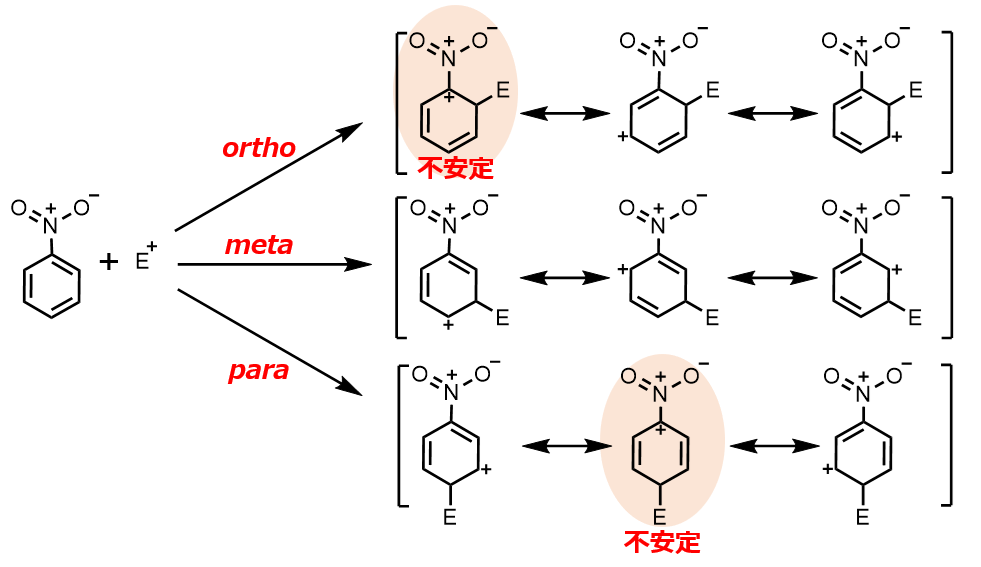
オルト位パラ位に付加した場合、正電荷が隣り合わせの非常に不安定な共鳴寄与体が出てきてしまいます。
したがって、相対的にメタ位が安定となりメタ配向性となります。
まとめ
- N, Oなど非共有電子対を持っている原子が直接結合する場合は、強い活性化置換基となる
NH3, OH, OR… - C=Oは電子求引性の基である
- 炭化水素基は弱い活性化置換基として働く
- ハロゲンは弱い不活性化置換基として働く
- 芳香環に結合した原子に多重結合しているヘテロ原子(N, O)があると、強い不活性化置換基となる
どの置換基が電子供与性で、電子求引性で、、、というのは何度も目にしていると自然に覚えていくものですが、理解すると反応機構の理解にも役立ちますので早く覚えちゃいましょう!
-NH3が最強、-NO2が最弱、C=Oが電子求引性、ということだけでも頭に入れておくと、全体が見えやすくなりますよ~

コメント