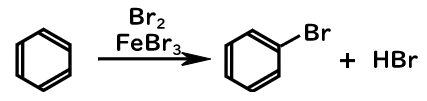
ベンゼンの臭素化
ベンゼンの塩素化

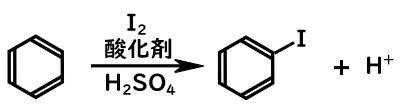
ベンゼンのヨウ素化
ブロモベンゼンおよびクロロベンゼンは、ベンゼンと単体臭素、塩素の反応を触媒下で行うことで進行します。
またヨードベンゼンは、酸性条件下で、単体ヨウ素と酸化剤を用いてベンゼンと反応させることで得られます。
これらの合成法は工業的なもので、実験室的にはSandmeyer(ザンドマイヤー)反応を用いて合成するのが一般的みたいです。
フルオロベンゼンの合成は?と思うかもしれませんが、そもそもフッ素単体の反応性が非常に高いため確保が難しいですし、ガラスをはじめ大体の金属を溶かすフッ化水素が発生してしまうので扱いが困難なためだと考えられます。
ちなみに、クロロベンゼンとクロラールの反応で、昔使われていた有名な殺虫剤、農薬であるDDT(ジクロロジフェニルトリクロロエタン)が合成できたりします。

反応機構
臭素化・塩素化
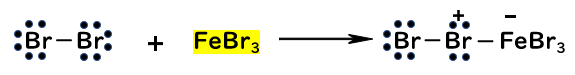
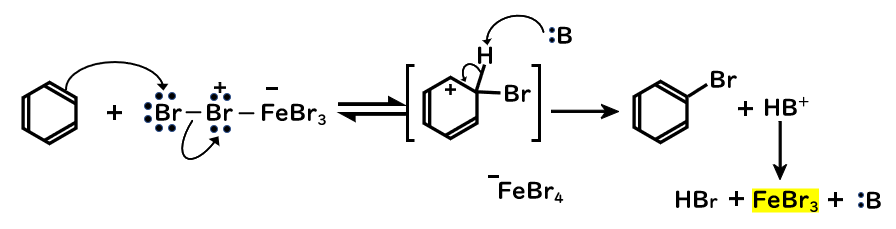
- Br2がFeの空の軌道に結合して、末端のBrが求電子的になる
- ベンゼンが求電子的なBrに対して求核攻撃することで、Brが付加
- 塩基(溶媒、–FeBr4)がプロトンを引き抜いて、芳香環が再形成
- プロトン化した塩基は、–FeBr4と反応してFeBr3を再生
塩素化の機構も全く一緒で、Br2をCl2に、FeBr3をFeCl3に置き換えれば塩素化となります。
また、FeBr3がBr2の電子をFeの空の軌道に受け入れる役割をしていますが、これはLewis酸と呼ばれます。
あと、引き抜かれるプロトンはハロゲンの付加した炭素に結合している水素というのに注意してください
ヨウ素化
ヨウ素化でも、求電子剤の発生法以外は基本的に同じです
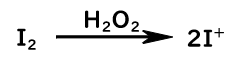
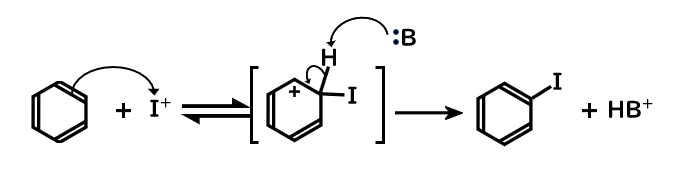
- ヨウ素が酸化剤(過酸化水素や硝酸)により酸化され、ヨウ素陽イオンとなる
- ベンゼンが求電子的なI+に対して求核攻撃することで、Iが付加
- 塩基がプロトンを引き抜いて、芳香環が再形成
見てわかる通りヨウ素陽イオンが発生した後は、全く同じ機構で進行しています。
芳香環が求電子剤を攻撃して付加、そしてプロトンが引き抜かれるという流れは定番です。
反応について
FeBr3とFeCl3の失活【湿気】
臭化鉄 FeBr3 および塩化鉄 FeCl3 は、空気中の水分と反応して失活してしまいます。
それは、H2Oが孤立電子対をもっているのでFeの空の軌道に配位してしまい、軌道が水に使われてしまうためです。
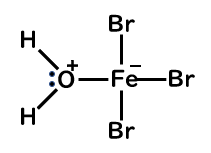
そのため、FeBr3やFeCl3をそのまま用いるのではなく、鉄粉と臭素、塩素を使って反応系中で生成させます。
2 Fe + 3 Br2 → 2 FeBr3
2 Fe + 3 Cl2 → 2 FeCl3
共鳴について
反応機構中のカッコで囲まれた中間体は、共鳴していることを表します。
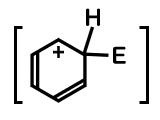
中間体の共鳴寄与体は次のように描けます。
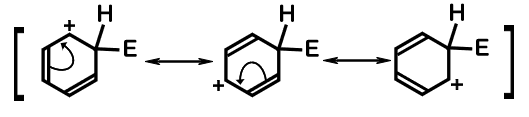
まとめ
- ベンゼンに臭素/塩素とFeBr3/FeCl3を反応させてブロモ/クロロベンゼンを発生
- 酸性条件下、ヨウ素に酸化剤を加えてヨウ素陽イオンを発生、ベンゼンに反応させることでヨードベンゼン生成
- とにかく↓の反応機構が頻出!!!!

ニトロ化やスルホン化、Friedel-Crafts(フリーデルクラフツ)反応の機構もすべて同じなので、これさえ押さえておけば、それらの反応を理解したといっていいでしょう。



コメント