ベンゼンのニトロ化
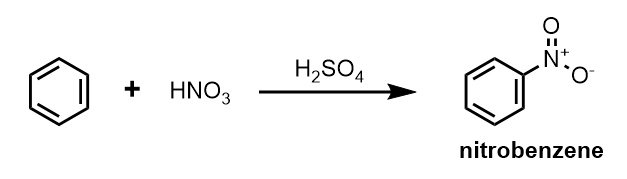
ベンゼンは硝酸と硫酸の混酸に反応し、ニトロ化(NO2=ニトロ基)されます。
ニトロ基自体は硝酸由来だから硝酸だけでも良さそうですが、なぜ混酸を使うのでしょうか?
それを理解するには芳香族求電子置換反応について知る必要があります。
また、ニトロ化した化合物の使い道についても解説します。
反応機構
ハロゲン化、スルホン化、ニトロ化、Friedel-Crafts反応は全部芳香族求電子置換反応という反応形式をとります。
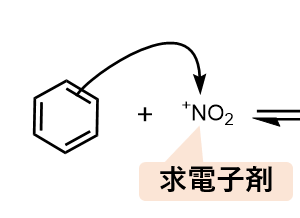
芳香族求電子置換反応が何だったかというと、電子豊富な芳香族に電子不足な求電子剤が付加することで始まる反応です。
ニトロ化の場合の求電子剤は、+NO2(ニトロニウムイオン) です
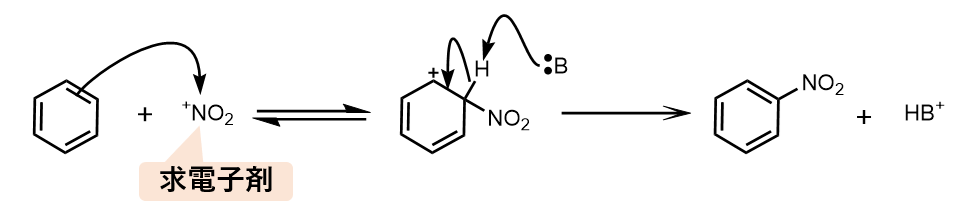
- 求電子剤(+NO2)がベンゼン環に付加する
- 塩基(H2O, HSO4–)がプロトンを引き抜いて、芳香環を再形成
ニトロニウムイオン源
結論から言うと、求電子剤となるニトロニウムイオンを得るために混酸を使用します。
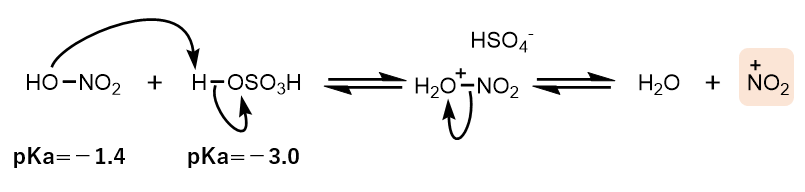
硝酸よりも硫酸の方がpKaが低く、より強い酸なので、硝酸はプロトン化され得ます。
続いて水が脱離することで、ニトロニウムイオンが生成します。
反応について
ニトロ化化合物の使い道
ニトロ基(-NO2)は強い電子吸引性基であり、ベンゼン環をめちゃくちゃ(置換基で最も)不活性化します。
つまり、ベンゼン環の電子を吸い取って電子密度を低下させるため、芳香族求電子置換反応が起こりにくくなります。例えば、遅い芳香族求電子置換反応のFriedel-Crafts反応に対しては、ニトロベンゼンは反応しません。
強い電子吸引性基のニトロ基は、主に次の方法で強い電子供与性基のアミノ基(-NH2)に変換することができます。
- パラジウムカーボン(Pd/C)を用いた接触水素化
- Fe, HClを用いたBechamp(ベシャン)還元
- Sn, HClを用いた還元
パラジウムカーボンは、活性炭にパラジウムを担持させた黒い粉末であり、水素添加反応に汎用されます。
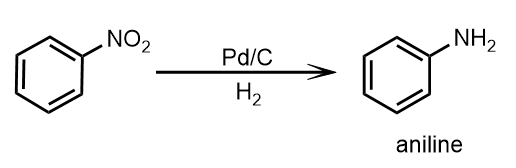
ベンゼン環からしてみれば、最悪の敵だったのが、最高の味方になる激アツ展開ですね。
※アミノ基はベンゼン環を最も活性化させますが、Friedel-Crafts反応においては錯体を形成して不活性化基となるため反応が起こりません。
また、アミノ基はNaNO2, HClから発生するニトロソニウムイオン(+NO)から、ジアゾニウム塩へと変換することができます。
また、ジアゾニウム塩はSandmeyer反応により様々な基を置換することができます。
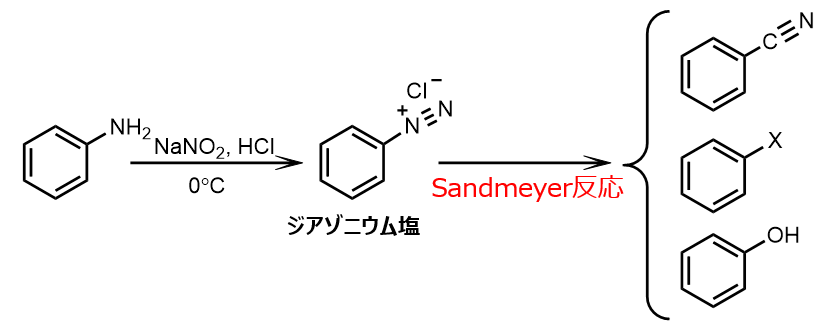
こういう風に、生成した化合物のその先を合わせて見ておくと、イメージしやすくなるのでオススメです。
まとめ
- ニトロ化は硝酸と硫酸の混酸により行い、ニトロニウムイオン(+NO2)が求核剤となる芳香族求電子置換反応である。
- 混酸を用いるのは、硝酸からプロトンを引き抜いて、ニトロニウムイオンを発生させるため

コメント