【不活性溶媒中】アルケンへのBr2の付加
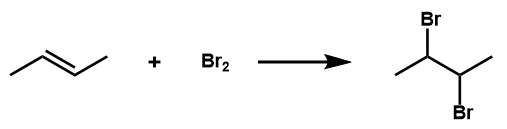
不活性溶媒中(CH2Cl2 etc…)で、アルケンに対してハロゲンが付加するとビシナルハロゲン化物(二つのハロゲンが隣接する炭素についているもの)が生成します。
【水存在下】アルケンへのBr2の付加
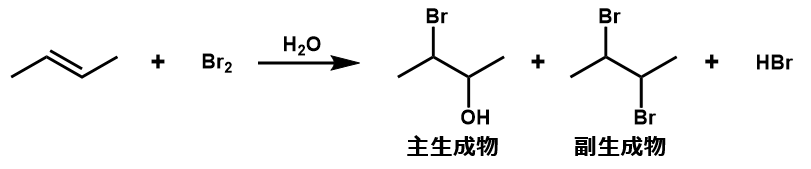
活性な溶媒として、例えば水が存在していると、主生成物はハロヒドリンとなります。
まず、電子豊富な二重結合の付加には電子不足の求核剤が必要なわけで
・ハロゲン化水素付加→H-XのH(ハロゲンに引っ張られてδ+を帯びているため)
・水, アルコール付加→H+(酸触媒に由来する)
でしたが、ハロゲン付加では求核剤は、X-Xがアルケンへ近づいて一時的に分極したものに由来します。
また、水が存在すると違う生成物を与えますが、反応機構を見ればどちらの反応も同じようなことが起きていると分かるので、機構から理解しておきましょう!
反応機構
不活性溶媒中
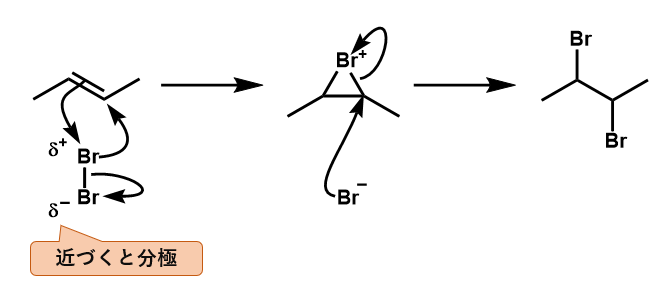
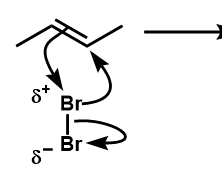
- ハロゲン(X2)は二重結合に近づくと分極し、δ+に帯びた方が二重結合に求電子攻撃する。
このとき、ハロゲン原子はデカいのでもう一方の炭素と結合を形成し環状(不安定な三員環)になる。
また、他方のハロゲン原子は電子を持って行ってBr–となる。 - 環状部分の炭素は、臭素に電子を引っ張られて電子不足になっているために、Br–の求核攻撃を受けて環を解消する。
水存在下
溶媒などで水を用いた場合は、上の1で発生するBr‐よりもH2Oの方が多量に存在するので、2段階目ではH2OのOが優先して求核します。
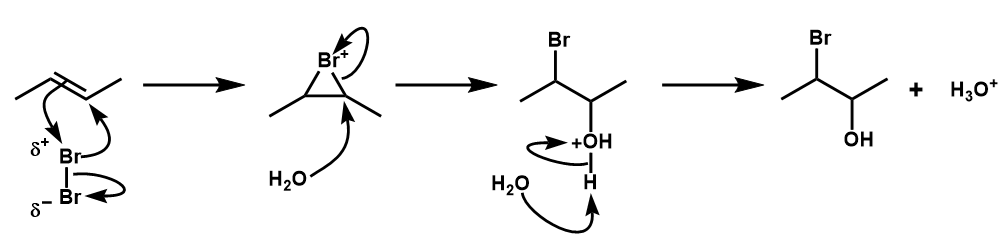
- 上と同じ
- 環状部分の炭素は、臭素に電子を引っ張られて電子不足になっているために、多量に存在するH2Oの求核攻撃を受けて環を解消する。
このとき、どちらの炭素につくのかを考慮する必要があります。(今回の例ではどっちでも同じ生成物ができるため考えなくてよい) - 生成した中間体は、Brが電子を引っ張るため強い酸です。
よって、水がプロトンを受け取って、より弱い酸のH3O+が遊離します。
求核剤は何も水だけというわけじゃなくて、アルコール、塩素イオンなど、求核性をもつものです。
反応について
求核剤が付加する方の炭素
水存在下の反応のように、求電子剤(Br+)と2段階目の求核剤(H2O)が異なる場合、求核剤が環状炭素のどちらに結合するかによって生成物が変わります。
例えば、プロペンの場合を見てみましょう
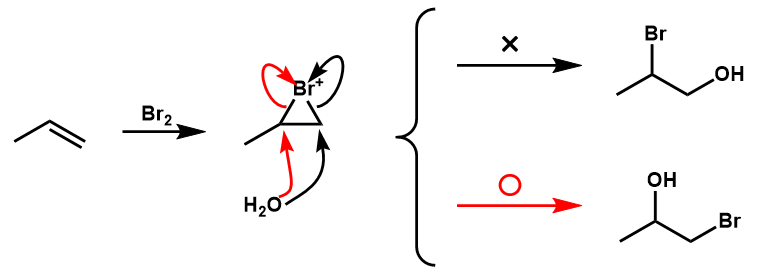
求核剤であるH2Oは真ん中の炭素にのみ付加し、結果として赤い方の1-bromopropan-2-olしか生成しません。
勘の良い方はお気づきかもしれませんが、これにはカルボカチオンの安定性が関係してきます。
求核剤が付加する段階の遷移状態を見てみると、H2Oが結合するよりもC-X結合の切断の方がより進行しているために、切れるC-X結合のCはδ+を帯びることになります。
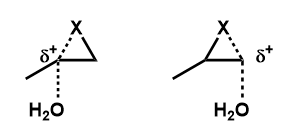
カルボカチオンの安定性は
第三級 > 第二級 > 第一級
なので、上の例では左:第二級 右:第一級であり、左の遷移状態の方が安定となるため、真ん中の炭素にH2Oが付加します。
つまり、マルコフニコフ則に従うわけです。
まとめ
- ジクロロメタンなどの不活性溶媒中では、ハロゲンがアルケンに付加すると、ビシナルハロゲン化物が生じる
- 溶媒として水やアルコールなどを用いると、反応の二段階目で求核剤として作用し、ハロゲンに優先して結合を形成する。
- 二段階の求核剤付加はマルコフニコフ則に従う。

コメント