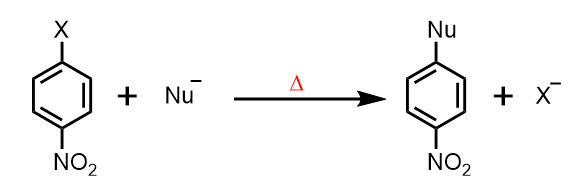
SNAr反応
芳香環に置換基を導入する方法として、ハロゲン化、スルホン化、ニトロ化、Friedel-Crafts反応といった芳香族求電子置換反応があります。
しかし、ニトロ基などの不活性化置換基が入ってしまうと芳香環の電子密度が低下し、芳香族求電子置換反応に対して反応性が低下するので、求電子置換では次の置換基が入れにくくなってしまいます。
そこで、逆に電子密度が低くなっていることを利用して、芳香族求核置換反応により置換基を導入する方法があります。
たとえば、ハロゲンとそのオルト/パラ位に電子求引基がついていると、その分子はSNAr(アリール)反応によりハロゲンの部分を変換できます。
反応機構
例えば、パラ位に付いていた場合はこのような共鳴をとって反応します。
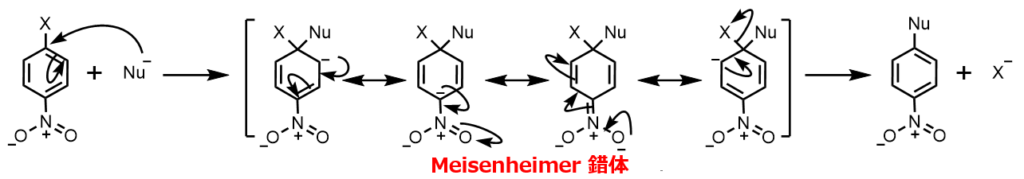
- 求核剤(Nu-)はハロゲンの結合した炭素に求核攻撃して付加して、カルボアニオンが生成する
- このカルボアニオンは共鳴を繰り返し、ハロゲンが脱離する
求核剤が付加して生成するカルボアニオン中間体はMeisenheimer(マイゼンハイマー)錯体と呼ばれます。
ここで、求核剤はハロゲンよりも強い塩基でなければなりません。
例えば、Br–は弱塩基(共役酸のHBrが強酸)なので、HBrよりも弱い酸の共役塩基ならば置換されます。
弱い塩基ほど脱離能が高いという基本を思い出しましょう。
反応について
オルト/パラ位に電子求引性がないとダメなのはなぜ?
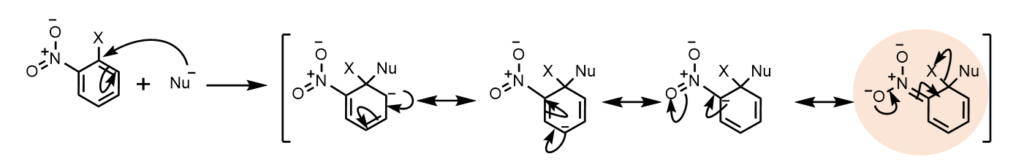
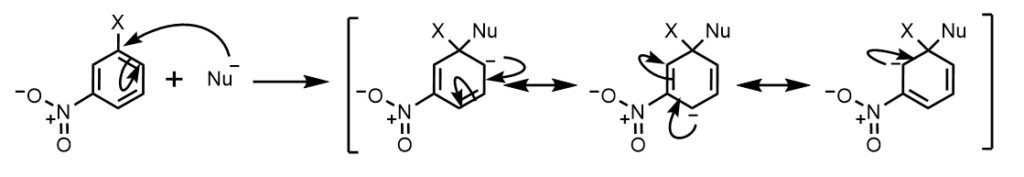
オルト位、パラ位(前の図)、メタ位に電子求引性の基があったときの共鳴寄与体を見てみましょう。
オルト位
メタ位
共鳴寄与体から分かるように、オルト位とパラ位に電子求引基があった場合は、電子求引基に電子が移動できる、すなわち電子求引基に電子が非局在化していることが分かります。
メタ位では、電子求引基に電子が非局在化できないため、うまく電子を引っ張れておらず、ハロゲンが脱離することができません。
反応例
たとえば、p-ニトロアニリンをベンゼンから合成する経路を考えてみましょう。
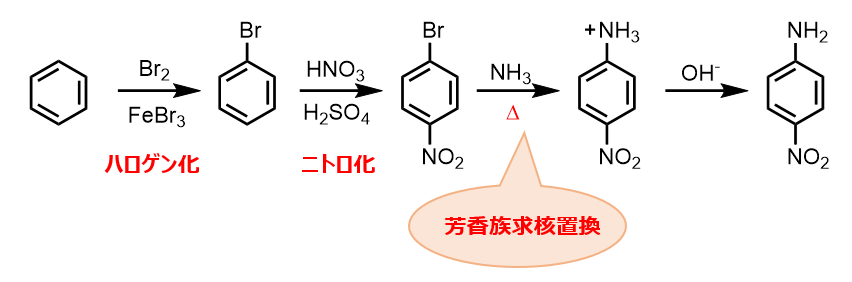
①ハロゲン化:芳香環のブロモ化は臭素とFeBr3を用いればいいんでしたね。
②ニトロ化:ニトロ化は硝酸と硫酸の混酸を用いてニトロニウムイオン(+NO2)を発生させるんでしたね。
(この際、ハロゲンはオルト/パラ配向性なのでオルト位の副生成物が予想されますが、臭素の立体障害もあり、パラ位が多く得られると期待されます)
配向性について詳しくは活性化/不活性化置換基と配向性をご覧ください。
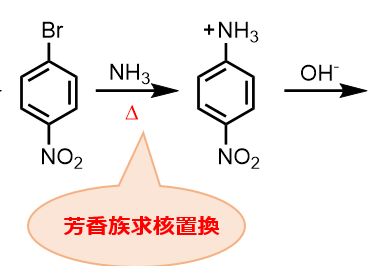
③芳香族求核置換反応:ここでの求核剤はNH3です。負電荷を持っていませんが、非共有電子対を持つためにNH3は求核剤として働くことができます。
④塩基処理:このままではカチオンのままなので、適当な塩基でプロトンを引き抜きます。
余談:別経路での合成を考える

ベンゼン→(ニトロ化)→ニトロベンゼン→(Bechamp還元)→アニリン→(ニトロ化)→p-ニトロアニリンの方がよくない?
一見、この経路の方が短く見えますが、アニリンのニトロ化には問題があります。
ニトロ化には強酸を用いるため、アニリンはアニリニウムイオンとなってしまいます。アニリニウムイオンは不活性化基でありメタ配向性でしたね。したがって、パラ位にニトロ基を導入することができなくなってしまいます。
そのため、アニリンからのp-ニトロアニリンの合成では、アニリンを一度アセチル基で保護してオルト/パラ配向性を保ったままニトロ化が行われ、その後に脱保護されます。
このように、反応によっては問題が生じる経路もあるので、反応条件をよく確認しましょう!
まとめ
- 置換基としてハロゲン&オルト/パラ位に電子求引基がついた芳香環は、芳香族求核置換反応(SNAr反応)を起こすことができる。
- ハロゲンよりも強い塩基の求核剤を加えて加熱すると、ハロゲンが置換される。

コメント