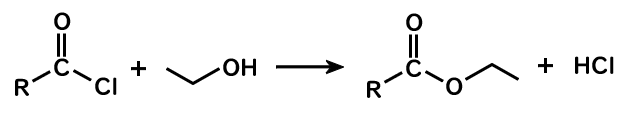
塩化アシル+アルコール→エステル
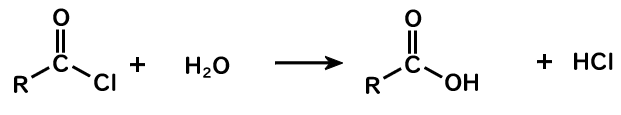
塩化アシル+水→カルボン酸
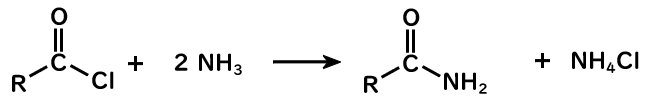
塩化アシル+アミン(アンモニア)→アミド
カルボニル炭素(C=O)を含んだ、R-CO-の構造はアシル基と呼ばれ、カルボン酸誘導体の一つです。
カルボニル基は、Oが電子を引っ張っているために、Oがδ-、Cが δ+に分極していて、Cは求核攻撃を受けることができます。
アシル反応で利用しているのは、
アシル基についている脱離基の塩基性により、カルボニル炭素の求電子性(+の度合い)が変わる
という性質です。
これを利用して、ハロゲン化アシル(塩化アシルが多い)をエステルやカルボン酸、アミド(RCONR’R”)に変換することができます。
また、この性質と考え方については後で解説します!
考え方が分かれば、暗記する必要は全くないので、ぜひ理解しましょう。
反応機構
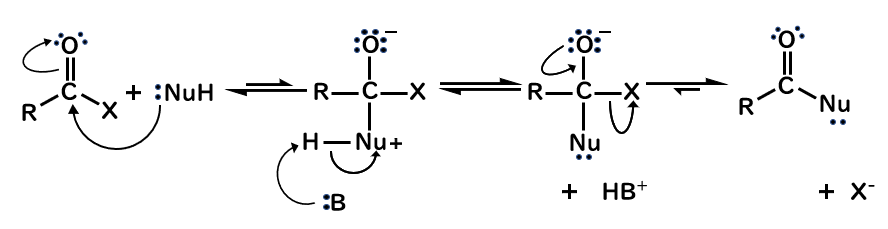
- 求核剤が、電子不足なカルボニル炭素を攻撃して付加し、四面体中間体を生成
- 塩基(B)がプロトンを引き抜く
- より弱い塩基であるハロゲンが脱離し、酸素の電子が炭素と二重結合を作る
たとえば求核剤にメタノール、つまりNu=CH3Oを図に当てはめてみると、生成するのはエステルとなります。
水、つまりNu=OHでは、生成するのはカルボン酸ですよね。
そして、アミンやアンモニアのときは、Nu=NR’R”ですから、アミドが生成します。
注意してほしいのが、カルボニルの反応では、求核剤がカルボニル炭素を攻撃すると同時に脱離基が脱離するSN2反応や、脱離基が脱離してカルボカチオンを経由して求核攻撃を受けるSN1反応のような機構ではありません。
アシルの反応が、SN2反応やSN1反応と違うのは、求核剤と脱離基がどっちもついた状態の四面体中間体を経由するという点です。
反応について
【重要】反応性の違い
塩化アシル、エステル、カルボン酸、アミドの反応性を比べると、次のような順序になります。

アシル化合物と求核剤を混ぜ合わせても、それだけでは自身より反応性の高い化合物になることは出来ません。
したがって、塩化アシルはエステル、カルボン酸、アミドになれますが、アミドはどれにもなれません。エステル、カルボン酸はアミドに変換できます。
カルボン酸とエステルは同程度の反応性なので、交換反応が起こります。
理由
先に述べた通り、脱離基の塩基性によりカルボニル炭素の求電子性(+の度合い)が変化することで、反応性が決まります。
そもそも(Lewis)塩基性は、電子を与える能力だと考えていいので、塩基性が強い脱離基はカルボニル炭素に電子を与えようとするため、+の度合いが弱まります。
その結果、反応性が低いということになります。
じゃあ、脱離基の塩基性の強弱はどうやって分かるのか、ですが、共役酸/塩基について思い出してみてもらえると分かりやすいです。
脱離基となる塩基はそれぞれ、Cl–、RO–、OH–、NH2– ですから、共役酸は、HCl、ROH(アルコール)、H2O、NH3ですよね。
この共役酸の酸性の強さは言わずもがな、HCl>ROH(アルコール)≒H2O>NH3ですから、
共役酸の酸性が強いほど、その塩基の塩基性が弱い
ということを合わせると、塩基の強さは、Cl–<RO–≒OH–<NH2– になると分かります。
これゆえに、反応性が 塩化アシル>エステル≒カルボン酸>アミド となるのです。
正確に言えば、脱離基のpKaから塩基性の強弱を考えるものですが、見当をつけるだけだったら、
塩酸が強酸で、水とアルコールが中性、アンモニア(アミン)が塩基性という小学校理科と、
皆さんご存知の共役酸と塩基の関係を考えるだけで反応性が分かるので、全く覚える必要はありません。
アミンが2当量必要なのはなぜ?
アミンやアンモニアを反応させるときには、2当量以上必要となります。
例えば、塩化アシルにエチルアミンが1当量反応したとき、次のような生成物ができます。

エステルやカルボン酸の合成同様、酸(HCl)が発生しています。
その結果、非共有電子対をもつアミンが、次のようにしてプロトン化されてしまいます。

プロトン化されたアミンは、プロトンに非共有電子対を使われてしまったので、求核剤として攻撃することが出来なくなります。
そこで、求核剤不足になるのを防ぐために、もう1当量分のアミンを、プロトン化され要員とすることで非プロトン化の求核剤を確保します。
まとめ
- ハロゲン化アシルは反応性が高く、アルコール、水、アミンと反応して、それぞれエステル、カルボン酸、アミドを生じる。
そして、それらの化合物は、ハロゲン化アシルより反応性が低い。 - 反応の途中、四面体中間体を経由する
- アミン(アンモニア)を反応させるときは、2当量必要



コメント