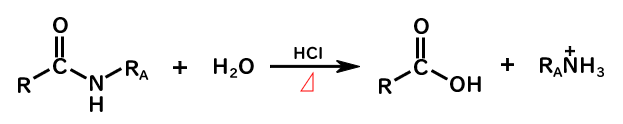
酸性条件のアミドの加水分解
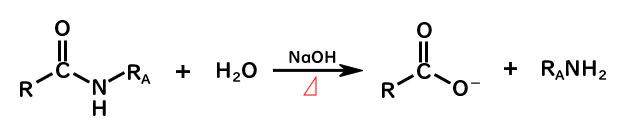
塩基性条件のアミドの加水分解
アシル化合物の一種であるアミドRCONR1R2は酸を加え、熱をかけることで加水分解されます。
また、水酸化物イオンを加えて、熱をかけることでも加水分解できます。
一方で、網戸はポリプロピレンが原料なので加水分解されません…
- 反応性

アシル化合物の反応性は上の通りで、
酸触媒でエステル→カルボン酸とする加水分解や水酸化物イオンを用いてエステル→カルボン酸とするけん化
は同じくらいの反応性であるエステルとカルボン間の交換反応なので、反応が進むというのも分かります。
実は、反応性が一番低いアミドも、酸触媒&熱もしくは水酸化物イオン&熱を加えることで加水分解できてしまいます。
反応機構
酸触媒による加水分解
長いので3stepに分けてみます
Step1 カルボニル酸素のプロトン化と求核剤の付加

- 酸により、カルボニル酸素がプロトン化される
- カルボニル炭素に、水が求核剤として付加して、プロトン化した四面体中間体が生成
Step2 四面体中間体の平衡

- 塩基がプロトンを引き抜く
- 窒素がプロトン化される
もちろん、真ん中の四面体中間体のOHが再びプロトン化されて左の中間体に戻ったり、
右の四面体中間体から塩基がプロトンを引き抜くのも起こります。
Step3 アミン(アンモニア)の脱離と脱プロトン化

- アミンの脱離とともに、カルボニル基が再生する
- 脱離したアミンが塩基としてプロトンを引き抜いて、カルボン酸を生成
気付いた方もいらっしゃると思いますが、この反応機構はエステルの酸触媒加水分解とほとんど同じです。
ただ、エステルの加水分解と違う重要な一つの点は、
Step3において、エステルの加水分解では溶媒が塩基としてプロトンを引き抜いて、カルボン酸とアルコールを生成しますが、
アミドの加水分解では、脱離したアミンがプロトンを受け取り、カルボン酸とアンモニウムイオン(アミニウムイオン)となります。
アンモニウムイオンはカチオンですから、求核性などあるはずもなく、最後の段階は不可逆反応となります。
塩基性条件の加水分解

- 水酸化物イオンがカルボニル炭素に求核攻撃する
- ①ルート:NH2基が脱離するとき、カルボン酸が生成する
②ルート:水酸化物イオン(2当量目)によりプロトンが引き抜かれる - ①ルート:カルボン酸とアンモニアイオン(NH2–)が即座に酸塩基反応して、カルボキシラートイオンとアンモニアを生じる
②ルート:NH2基が脱離して、カルボキシラートイオン(塩)とNH2–が生成 - ②ルート:NH2–は水と反応して、NH3とOH–に交換される
①ルートについて
水酸化物イオンによるエステルの加水分解で、脱離後にカルボン酸とアルコキシドイオンが反応して、カルボキシラートイオンとアルコールになるのと同様に、
カルボン酸とアンモニアイオン(NH2–)が反応して、カルボキシラートイオンとアンモニアになります。
アンモニアイオンよりも、カルボキシラートイオンの方が弱い塩基なので後者に変換されます。
②ルートについて
二次のアニオンが生成し、アンモニアイオンが脱離しますが、溶液には水が存在しているので
アンモニアイオンが塩基、水が酸として働いて、アンモニアと水酸化物イオンとなります。
これも、アンモニアNH3が塩基であり、そこからプロトンが取られたアンモニアイオンNH2–は非常に強い塩基ですから、中性の水の共役塩基である水酸化物イオンの方がまだマシなので、NH2–がプロトンを奪い去ると考えると分かりやすいです。
反応について
アルコーリシス反応
アミド→カルボン酸の加水分解がいけるのと同様に、アミド→エステルのアルコーリシス反応もいけます

加水分解では水が求核剤だったのに対して、アルコーリシスでは求核剤がアルコールになっただけで、反応機構も一緒と考えていいでしょう。
まとめ
- アミドは酸触媒&熱を加えることで加水分解し、カルボン酸とアンモニウムイオンを生成
- 水酸化物イオン&熱を加えることでも加水分解し、カルボキシラートイオンとアミンを生成
- 酸による加水分解の反応機構では、カルボニル酸素のプロトン化と四面体中間体を経る
- 水酸化物イオンによる加水分解では、アンモニアイオンが生じるが、生成したカルボン酸あるいは水と反応して、アンモニアとなる
- アミドとアルコールの反応も、酸触媒&熱を加えることで進行し、エステルを与える




コメント