エステルの酸触媒による加水分解(水酸化物イオンによる加水分解はこちら)

エステル交換反応
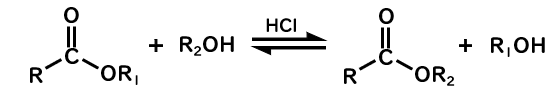
エステルをよく見てみると、RC=O基を持つので、アシル化合物(カルボン酸誘導体)の一種だと言えます。
高校の有機化学では、エステルに水を加えて分解すると、カルボン酸とアルコールが生成される~とかわけもわからず覚えていたと思いますが、中身を見てみると、ハロゲン化アシルの反応と同様の求核付加脱離反応をしています。
ところで、アシル化合物の反応性の序列を思い出してみると、

なので、エステルは別のエステル、カルボン酸もしくはアミドになることができます。
エステル→カルボン酸の加水分解、エステル1→エステル2のエステル交換反応の反応機構は全く同じなので、まとめて理解しておきましょう。
ハロゲン化アシル(塩化アシル)の反応の反応機構を知っている方は、

塩化アシルも同じアシル化合物だし、塩化アシル→エステルorカルボン酸orアミドの反応機構と同じじゃないんか?
と思うかもしれませんが、エステルの脱離基である-ORは、塩化アシルの脱離基の-Clよりも強い塩基なので、カルボニル炭素の求電子性が低下していて、そのままでは反応が遅いのです。(詳しくはハロゲン化アシルの反応を参照)
そこで、酸触媒を用いるんですが、ハロゲン化アシルの反応との違いは、
酸により、カルボニル酸素がプロトン化される
という点です。
ここでは、加水分解を例に反応機構を解説します。
反応機構(加水分解)
どのエステルの加水分解をしても、カルボン酸とアルコールを与えますが、反応機構を見てみると、ORのアルキルが第1級、第2級のときと、第3級のときで違います。
R1=第1級、第2級アルキル
少し長いので3ステップに分けて見てみましょう。
Step1 カルボニル酸素のプロトン化と求核剤の付加

- 酸により、カルボニル酸素がプロトン化される
- カルボニル炭素に、求核剤として水が付加して、プロトン化した四面体中間体が生成
Step2 四面体中間体の平衡

- 塩基がプロトンを引き抜く
- エステル由来の脱離基の酸素がプロトン化される
ここで忘れないでほしいのが、可逆反応であるという点です。
真ん中の中間体について、OH基がプロトン化される場合もあれば、OR基がプロトン化される場合もあり、必ずしも順方向(図の右方向)に進む訳ではありません。
同様に、左の中間体から水が脱離すればエステル(プロトン化)が、右の中間体からOR基が脱離すればカルボン酸(プロトン化)が生成します。
Step3 アルコールの脱離と脱プロトン化

- プロトン化されたエステル由来脱離基の脱離(アルコール生成)とともに、カルボニル基が再生
- 塩基がプロトンを引き抜き、カルボン酸が生成、酸触媒が再生
反応機構を見ての通り、すべてが可逆反応となっています。勘のいい方はわかるかもしれませんが、
カルボン酸がプロトン化されて、アルコールが求核攻撃して、、、のように反応機構の逆を辿ることによって、カルボン酸とアルコールから、エステルを生成できます。(step1のエステルと水をカルボン酸とアルコールに置き換えると、矢印も一緒になります)
酸触媒を用いた、カルボン酸とアルコールの反応はFischer(フィッシャー)エステル化と呼ばれます。
R=第3級アルキル
第3級のときは、SN1反応が起こります。

- 酸により、カルボニル酸素がプロトン化される
- カルボン酸が脱離して、第3級カルボカチオンを生成
- 求核剤として水が第3級カルボカチオンに付加
- 塩基がプロトンを引き抜く
第3級カルボカチオンは第1級、2級と比べてとても安定なので、カルボン酸が脱離してカルボカチオンの生成するルートが優先されます。(ちなみに、脱離基とは電子対を持っていく方の基です。)
カルボカチオンに水が付加する段階は不可逆反応なので、カルボン酸と第3級からエステルを合成するのは、この機構では無理そうです。
そうなると、第1級や第2級のときと同じ機構の逆が考えられますが、プロトン化されたアルコールのE2反応によるアルケン生成や立体障害などがあり、
Fischerエステル化は第3級アルコールへの適用が向いていないということになります。
反応について
生成物の収量の向上のために
R=第1級や第2級アルキルのときのエステルの加水分解では全部平衡なので、カルボン酸と水を1当量ずつ加えて放置するだけでは、カルボン酸やアルコールと同じくらいエステルが存在してしまいます。
そこで思い出してほしいのが、Le Chatelier(ルシャトリエ)の原理です。
例えば、水を過剰に加えた場合

過剰に加わった水を少なくしようとして、エステルと水が反応する順方向に平衡が傾きます。
エステル交換反応なら、原料のアルコールを過剰に加えればいいですね。
これにより、カルボン酸とアルコールの収量を上げることができます。
他にも、生成物のアルコールを減圧蒸留をして飛ばせば、それを補填するように平衡が右に動くので、アルコールの沸点次第では有効な手法ですね。
また、Fischerエステル化では、水の代わりにアルコールを過剰にすることで平衡を傾けます。
まとめ
- エステルと水の反応は加水分解、エステルとアルコールの反応はエステル交換反応
- 酸触媒はカルボニル酸素のプロトン化に使われる
- エステルのORのRが第1級、第2級のときは四面体中間体を経由
第3級のときはSN1反応を起こす - ルシャトリエの原理の考え方で、水を過剰に加えて平衡を右にずらす
加水分解は水酸化物イオンによっても促進することができます。
酸触媒とは別の働きにより反応速度を増大させるので、ぜひ合わせて理解しておきましょう。




コメント