塩化アシル→酸無水物、エステル、カルボン酸、アミド や 酸無水物→エステル、カルボン酸、アミドの反応のように、
アシル化合物では、より反応性の低い化合物に変換するのは簡単です。
なので塩化アシルさえ手に入れられれば、合成し放題というわけですね。

この中で一番身近にあるアシル化合物といえば、カルボン酸でしょう。
というわけで、カルボン酸から塩化アシルを合成できたらいいな~って感じですが、
幸いにも、変換する、つまり反応性を上げる(活性化する)方法があります。
①塩化チオニル SOCl2を用いて加熱
②三塩化リン PCl3を用いて加熱

この方法により、カルボン酸(塩)を反応性の高い塩化アシルに変換することができます。
テスト対策という意味では、変換の方法が重要で反応機構は出ないと思いますが、それだと暗記だよりになってしまうので、一度理解しておきましょう。
反応機構
塩化チオニル、三塩化リンのいずれを用いる場合も、中心元素のS, Pがδ+を帯びていて求核攻撃を受けることができるのを利用します。
塩化チオニル SOCl2 を用いた変換
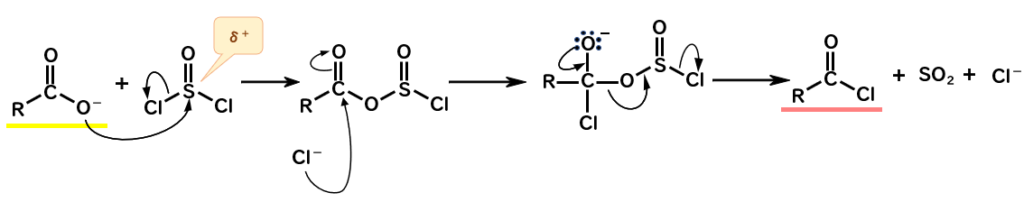
- 負電荷をもつ酸素が、δ+を帯びているS原子に求核攻撃して、Clが脱離 (SN2反応)
- Cl-がカルボニル炭素に求核攻撃して、四面体中間体を形成
- SO2&Cl-として脱離し、塩化アシルが生成
三塩化リン PCl3 を用いた変換

- 負電荷をもつ酸素が、δ+を帯びているP原子に求核攻撃して、Clが脱離 (SN2反応)
- Cl-がカルボニル炭素に求核攻撃して、四面体中間体を形成
- -OPCl2が脱離し、塩化アシルが生成
どちらの反応も、SN2反応→四面体中間体形成→弱塩基脱離という過程をたどっています。

Cl-は弱塩基(共役酸HClが強酸)だから、脱離能高いし、四面体中間体から脱離するのはClじゃないの?
と思うかもしれないですが、-OSOClや-OPCl2はそれ以上に塩基性が弱く、脱離に優れた基となっています。(だからこそ、SOCl2やPCl3から取れたCl-が反応して塩化アシルまで反応が進む)
ところで、この反応には見覚えがないでしょうか?
実は、アルコールをハロゲン化アルキルに変換する反応も、塩化チオニルや三塩化リンを用いて、同様の機構で進行します。
求核置換反応に対して反応性の低いアルコールを、高いハロゲン化アルキルにして活性化しているというのも同じ点ですね!
反応について
酸無水物にして活性化する
塩化アシルには劣りますが、酸無水物も十分反応性の高いアシル化合物です。
なので、酸無水物にすることでも活性化したと言えるでしょう。
酸無水物の分子の構造としては、2分子のカルボン酸から水が取れただけで、加熱すればできるんじゃないか?と思いがちですが、実際にはそう簡単にはいかず、
強力な脱水剤である十酸化四リンが必要になります。

十酸化四リンがリン酸などになりながら脱水して無水物を生成していくようです。
まとめ
- カルボン酸塩は、塩化チオニルSOCl2または三塩化リンPCl3を用いて
反応性の高い塩化アシルに変換される - 反応の流れは、S,P原子上のSN2反応→四面体中間体形成→脱離
- カルボン酸に十酸化四リンを加えて加熱することで、反応性の高い無水酢酸を合成できる




コメント