三臭化リンPBr3を用いたアルコールの変換

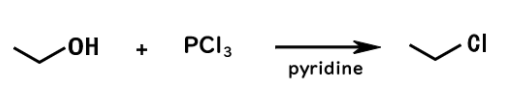
三塩化リンPCl3を用いたアルコールの変換
塩化チオニルSOCl2を用いたアルコールの変換

アルコールのOH-基は塩基性が強く、脱離能が低い*ため、求核置換反応を起こしません(反応性が低い)。
*塩基性が弱いほど、脱離能が高まる
そこで、求核置換反応を起こすためには、塩基性の弱い脱離基をもつハロゲン化アルキルに変換して「活性化する」必要があります。
ハロゲン化水素、つまり酸を用いてアルコールをハロゲン化アルキルに変換する方法のほかに、
三臭化リンPBr3 三塩化リンPCl3 塩化チオニルSOCl2
を用いてもハロゲン化アルキルに変換することができます。
反応機構
PBr3, PCl3を用いた場合
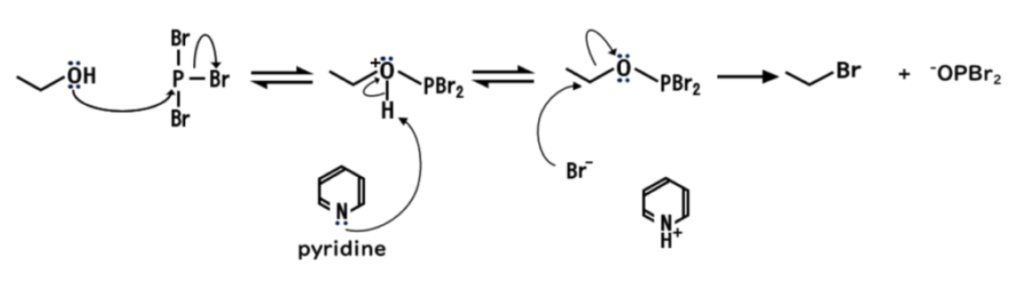
- まず、アルコール上の酸素がPBr3のリン原子に対して求核攻撃し、同時に臭素が脱離する
(つまり、リン原子上のSN2反応) - ピリジンが中間体よりプロトンを引き抜く
- 臭素イオンが求核攻撃し、SN2反応が起こる
ここで、臭化ホスファイト基(-OPBr2)は臭化物イオンよりも弱い塩基である(脱離能が高い)ので、 臭化ホスファイト基は、臭化物イオンにより置換されます。
PCl3を用いた場合も同様に進行し、塩化アルキルと塩化ホスファイトイオン(–OPCl2)が生成します。
SOCl2 を用いた場合

- アルコール上の酸素原子が、SOCl2の硫黄原子に対して求核攻撃し、同時に塩素が脱離する
(つまり、硫黄原子上のSN2反応) - ピリジンが中間体よりプロトンを引き抜く
- 塩素イオンが求核攻撃し、SN2反応が起こる
(二酸化硫黄が発生し、負電荷は塩素が引き受ける)
ここで、塩化スルファイト基(-OS(=O)Cl)は塩化物イオンよりも弱い塩基である(脱離能が高い)ので、 塩化スルファイト基は、塩化物イオンにより置換されます。
基本的に、機構は PBr3, PCl3 のものと変わりませんが、塩素の置換を受けるとき、塩素が負電荷を引き受けて、二酸化硫黄として脱離することに注意してください。
これらの反応では、プロトンの引き抜き役、つまり塩基としてピリジンが反応しています。
ピリジンは求核性が低いということもあり、溶媒としてよく用いられるのですが、ここでの中間体からプロトンを引き抜けるほどの弱い塩基性を持っています。
反応について
ハロゲン化水素による合成との違い
アルコールはハロゲン化水素を用いても、ハロゲン化アルキルに変換できると言いました。
ときに、2つの反応では生成物が異なることがあります。
2級アルコールの3,3-ジメチル-2-プロパノールの反応例を見てみましょう。
PBr3を用いる場合

PBr3のリン上のSN2反応による中間体生成の後、ピリジンのプロトン引き抜きで、真ん中の分子が生成しますね。
あとは、臭化物イオンの求核攻撃でSN2反応が起きて、元の立体配置と反転した生成物が得られます。
*注意*最初のSN2反応は、あくまでリン上で起こるので、原料の立体配置は反転しません。反転するのは、求核攻撃を受けた分子となります。
HBrを用いる場合

まず、酸より放出されたプロトンがヒドロキシ基に付加した後、水として脱離してカルボカチオンを生じます。
ここで思い出してほしいのが、カルボカチオンの転位です。
ここでは、隣のメチル基と正電荷が入れ替わることで、2級のカルボカチオンから、より安定な3級のカルボカチオンになることができます。
したがって、主生成物は3級のカルボカチオンに臭化物イオンが付加したエナンチオマー(鏡像異性体)対となります。
ちなみに、100%転位するわけではないので、副生成物として多少の2級のカルボカチオンに臭化物イオンが付加したやつも得られると考えられます。
まとめ
- アルコールの酸素原子がPBr3, PBr3ならPに、SOCl2ならSに求核攻撃して、Cl–, Br–イオンが脱離
- ピリジンがプロトンを引き抜く!!
- 遊離しているCl–, Br–イオンが中間体に対してSN2反応を起こして、立体配置の反転したハロゲン化アルキルが得られる!!
結果として、OH基とハロゲンが入れ替わり、立体配置の反転した生成物が得られるわけです。
この反応では、求核置換反応に対して反応性の低いアルコールから、高いハロゲン化アルキルに変換して活性化しています。
カルボン酸を活性化するときも、塩化チオニルや三塩化リンを用いるので合わせて理解することをおすすめします。




コメント