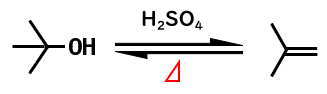
OH基と隣接する炭素に結合したHが脱離して、アルケンを生成する反応は脱水反応と呼ばれます。
スクロースの脱水で黒い柱状の炭が出てくるのはとても有名で、YouTubeでも、数百万回再生されているとある動画を見たことがある人は多いと思います(笑)。
高校の有機化学でも脱水反応はお馴染みだと思いますが、その反応機構について詳しく見ていきましょう。
アルコールの脱水の反応機構は、級数によって異なり、二級と三級ではE1反応が、一級ではE2反応が起こります。
反応機構
二級、三級アルコールのE1反応
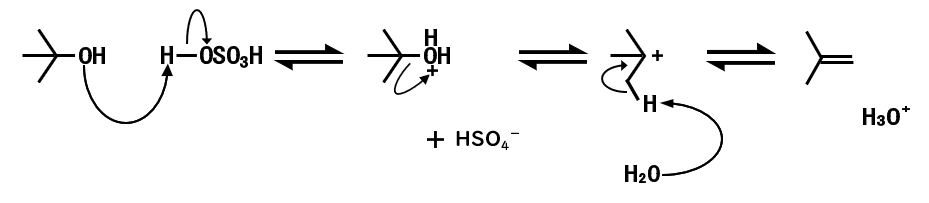
- 酸素原子が酸(硫酸)によりプロトン化される
- 脱離能が高い水が脱離して、カルボカチオンを生じる
- 水が塩基として、β炭素のプロトンを引き抜いてアルケンを生じる
一般論として、プロトン化される原子は、最も塩基性の強い原子です。
この場合、非共有電子対をもつ酸素原子が塩基性の高い原子なので、酸素原子がプロトン化されます。(たいてい、酸素原子か窒素原子がプロトン化されると思っていいと思います)
また、この反応では最後にH3O+が生成しているので、酸が再生しています。
したがって、加える酸(硫酸)は触媒量でいいことが分かります。
一級アルコールのE2反応
一級アルコールの場合、E2反応で進行しますが、SN2反応による置換生成物の生成を考慮する必要があります。
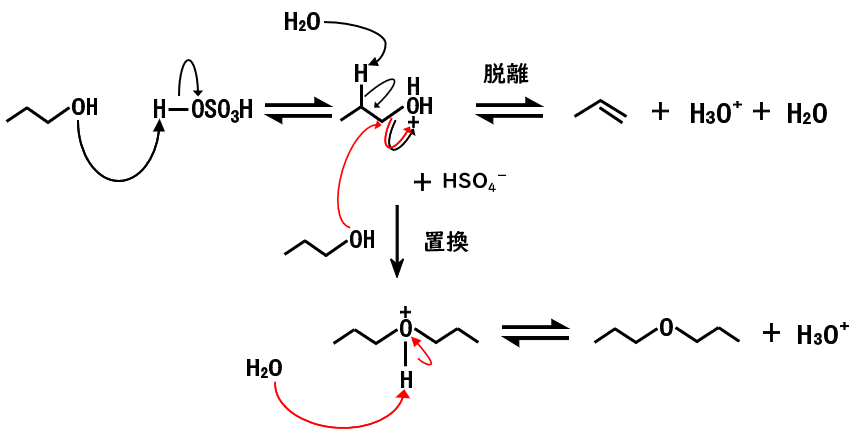
- 酸素原子が酸(硫酸)によりプロトン化される
- 脱離反応:塩基(H2O, ROH, ROR)がプロトンを引き抜くと同時に、水が脱離しながら、C-H結合の電子が移動することで、アルケンが生成する。
置換反応:アルコールが求核剤として働き、プロトン化したアルコールのα炭素に対して背面攻撃すると同時に、水が脱離する - 置換反応:塩基(H2O)が中間体からプロトンを引き抜き、エーテルが生成する
脱離反応において、プロトンを引き抜く塩基は、図中ではH2Oとしていますが、他のアルコールやエーテルでも引き抜くことが可能です。
置換生成物と脱離生成物の割合は、求核置換反応と脱離反応の競合にあるようにかさ高さによって変化し、よりかさ高くて塩基がβ水素に接近しやすい場合はE2反応、つまり脱離生成物の割合が高くなると考えられます。
反応について
二級カルボカチオンの転位
二級アルコールの脱水反応ではE1反応により、二級カルボカチオンが発生するため、隣の水素やアルキルが転位してより安定なカルボカチオン(三級カルボカチオン)が生成しないか常に注意する必要があります。
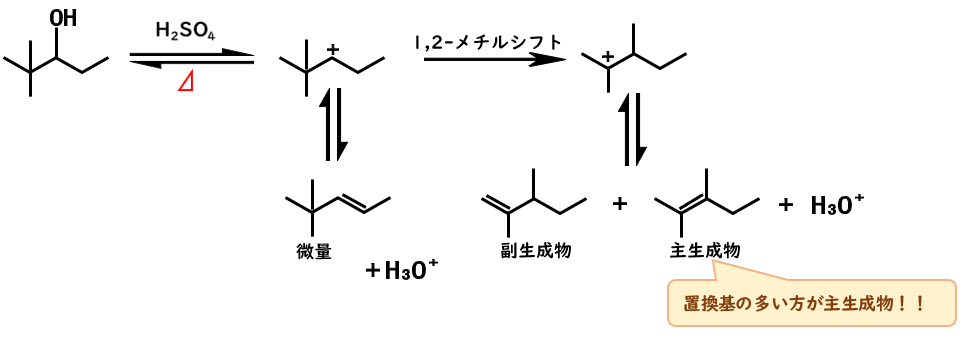
この図では、水の脱離で二級カルボカチオンが生じています。
ここで、隣の炭素についているメチル基が正電荷のある炭素に転位すると、三級のカルボカチオンになることができます。
よって、正電荷とメチル基を交換するようなイメージで転位して、三級カルボカチオンを生じます。
どのβ水素が引き抜かれるか?
上の図にある通り、主生成物は置換基の多いアルケンとなります
これは、置換基の多いアルケンがよりエネルギー的に安定なためです。
脱理反応において、置換基の多いアルケンが主生成物となる法則をZaitsev(ザイツェフ)則と呼びます。
一級アルコールE2脱離後のプロトン付加
1-ブタノールの脱水反応を見てみましょう。
先ほど解説した反応機構通り考えてみると、まずプロトンが付加して、E2反応で脱離して…
脱離生成物は1-ブテンが得られるはずです。
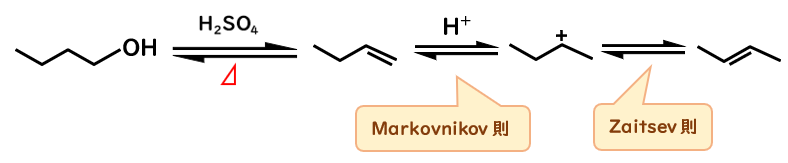
しかし、実際は二重結合が内部にある2-ブテンが得られます。
これは、溶液中のプロトンが二重結合部に付加することでカルボカチオンを生じるためです。
上の反応機構の例の1-プロパノールやエタノールを用いた場合は、生成したアルケンにプロトンが付加してカルボカチオンになろうが、結局脱離して同じアルケンになるので省略しています。
プロトンが1-ブテンの二重結合部に付加する際に、末端の炭素のほうに付加して、二級カルボカチオンを生じます。
これは、プロトンが付加するとき、二重結合をしている炭素のうち、最も水素が結合している炭素の方に付加する、というMarkovnikov(マルコフニコフ)則に従うためです。
なぜなら、最も水素が多く結合している炭素に付加すれば、より安定なカチオンを生成できるためです。(カルボカチオンの安定性:三級>二級>一級)
この場合、内部に付加すると一級カチオンが、末端に付加すると二級カチオンが生じるので、後者が選ばれます。
続いて、塩基が正電荷(をもつ炭素)の隣の炭素に結合している水素を引き抜いてアルケンを生じますが、脱離するときはZaitsev則に従います。
脱離して生成するアルケンは2-ブテンと1-ブテン(元に戻る)が考えられますが、より多置換なアルケン、つまり安定なアルケンは前者なので、2-ブテンが得られます。
プロトン付加のMarkovnikov則では、生成するカルボカチオンの安定性を比較!
プロトン脱離のZaitsev則では、生成するアルケンの安定性を比較!
シス・トランス選択性
2-ペンタノールの脱水反応を考えてみます。
2級アルコールなので、E1反応で脱離したあと、2-ブテンが主生成物となりますが、置換基の付き方によってシス(Z)-トランス(E)の幾何異性体が考えられます。
この時、トランス-2-ブテンの方が多く生成します。
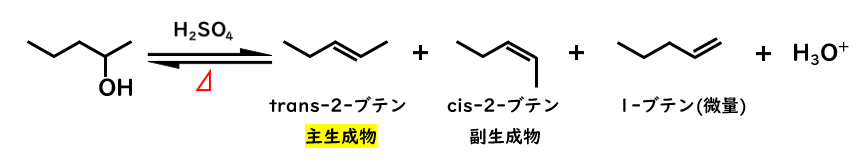
感覚的にも分かると思いますが、シス体は置換基どうしが近く、反発が生じるため、トランス体と比べてエネルギー的に不安定となります。
このため、より安定なトランス体が主生成物となるのです。
まとめ
- アルコールは、硫酸を加え、加熱することで脱水してアルケンを生成する
- アルコールがプロトン化された後、脱水する機構は
二級、三級アルコール → E1反応
一級アルコール → E2反応 - 二級アルコールのときは、カルボカチオンの転位に注意!
- より水素の多いほうに付加するMarkovnikov則、
置換基が多くなるように脱離するZaitsev則を覚えておく - 一級アルコールの脱水では、生成したアルケンにプロトンが付加してカルボカチオンを生成
- 幾何異性体が考えられるときは、トランス体が主生成物

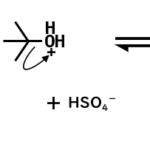
コメント