水酸化物イオンを用いた加水分解(けん化)
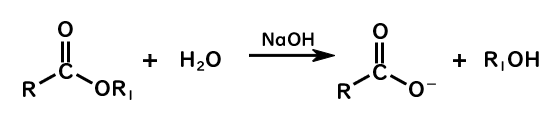
エステルの加水分解反応は、酸触媒により反応速度を増大させることができますが、
水酸化物イオンによっても反応が促進されることを覚えているでしょうか。
高校化学では、塩基を用いて油脂を脂肪酸塩とグリセリンに加水分解することをけん化と習ったと思いますが、
広義では、塩基を用いてエステルを酸の塩とアルコールに加水分解することもけん化と呼びます。
酸触媒によるエステルの加水分解では、カルボニル酸素がプロトン化されることでカルボニル炭素の求電子性が上昇し、反応速度が増大しますが、
水酸化物イオンを用いた加水分解では、水酸化ナトリウムなどを加えることで、優れた求核剤である水酸化物イオンを提供して反応を促進します。
酸触媒加水分解との違いは、
- 水酸化物イオン自体が求核剤として働くので、触媒ではない
- (酸触媒加水分解が可逆反応であるのに対して、)不可逆反応である
という2点です。
反応機構
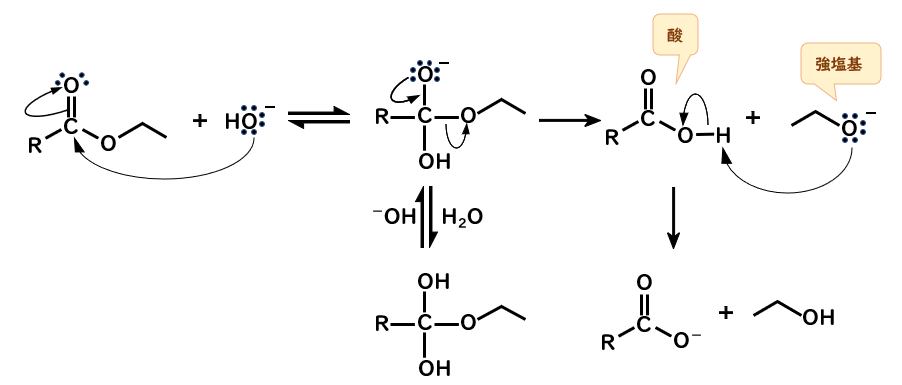
- 水酸化物イオンがカルボニル炭素に求核攻撃する
- 脱離し得る基として、OH基、RO基があるが、RO基が脱離したときにカルボン酸が生成する
(このとき、四面体中間体は負電荷をもつものと、中性のものとで平衡をとります) - アルコキシドイオン(強塩基)とカルボン酸(酸)の酸塩基反応が起こり、カルボキシラートイオンとアルコールが生じる
最後の段階について、カルボキシラートイオンはカルボン酸(弱酸)の共役塩基なので強塩基といえますが、
中性のアルコールの共役塩基のアルコキシドイオンはもっと強い塩基なので、カルボン酸とアルコキシドイオンでいるよりも、カルボキシラートイオンとアルコールでいた方がマシだと考えると分かりやすいです。

中性の四面体中間体からは脱離しないんか?
という疑問を持った方も、そうでない方にも覚えていてほしい、反応機構を考えるときの原則があります。
- 塩基性溶液では原則として、正電荷をもつ化学種を生成・経由しない反応機構をとる
- 逆も然り、酸性溶液では、負電荷をもつ化学種を生成・経由しない反応機構をとる
酸触媒によるエステル加水分解でも、反応機構を見てみると確かに負電荷をもつ化学種は経由していません。
そして、今回の水酸化物イオンを用いる加水分解では、正電荷をもつ化学種は経由していません。
さて、なぜ中性の四面体中間体から脱離基が脱離しないのか、ですが
脱離するときのことを考えると、脱離基が電子対を持っていき、酸素から電子が降りてきますが、そうなると酸素から結合3本ということで正電荷を帯びてしまいます。
塩基がプロトンを受け取るとしても若干酸素が正電荷を帯びる過程を経るので、塩基性溶液で正電荷をもつ化学種を経由しないという原則に反します。
反応について
エステル交換反応は促進できない
酸触媒を用いると、エステル→別のエステルの反応であるエステル交換反応が、加水分解とおなじ反応機構で反応速度を増大できます。
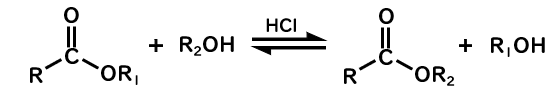
一方で、水酸化物イオンを用いても、それ自体が求核剤として働くため、カルボン酸が生成してしまいます。
そもそも加水分解では、求核剤として水と水酸化物イオンのどちらが反応しようが、同じ生成物を得るので使えていたわけです。
だからエステル交換反応では、アルコールの共役塩基であるアルコキシドイオンを使えば、どちらが反応しようがお求めのエステルが手に入るわけです。(例えば、エタノールを反応させるならエトキシドイオン)
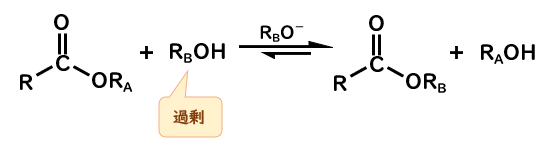
あとはルシャトリエの原理で、一方のアルコールを過剰にしたら平衡が傾いて収量よく望みのエステルが得られます。
ちなみに、アルコキシドイオンは
ROH + NaH → RO– + Na+ +H2
のようにしてアルコールと水素化ナトリウムの反応により得られます。
アルコキシドイオンが求核剤として働く反応は他にWilliamsonエーテル合成などが挙げられます。
まとめ
- けん化では、カルボン酸に対して水酸化物イオンが求核剤として働き、カルボキシラートイオンとアルコールが得られる
- 反応は、不可逆反応である
- エステル交換反応を塩基性条件で促進するなら、アルコール溶液に対応するアルコキシドイオンを加える




コメント