SN1反応はSubstitution(置換)-Nucleophile(求核)-1(単分子)の略であり、 SN2反応同様に求核置換反応を意味します。 SN2反応との違いはこれが単分子反応という点であり、反応の律速段階では、1分子自身以外は関与しません。
反応機構
三級ハロゲン化アルキルのSN1反応
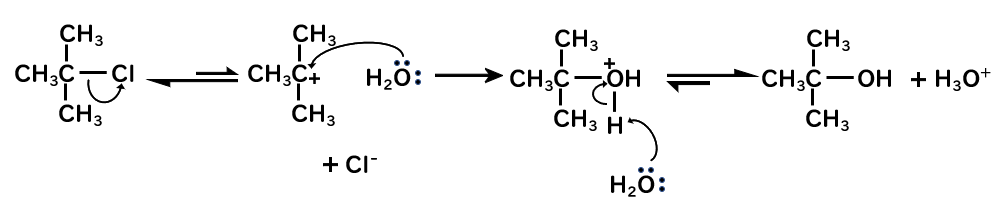
- 炭素とハロゲンの結合が開裂し、ハロゲンがその電子を持っていき、カルボカチオンが生成する。
- すぐに求核剤(水)が求電子剤(カルボカチオン)と反応して、プロトン化したアルコールが生成する。
プロトン化したアルコールは、中性型のアルコールと平衡をとりますが、その時の存在比は溶液のpHに依存します。
pH=7においては、ほとんどが中性型のアルコールとなるようです。
SN2反応は、求核剤の付加と同時に脱離が起こる協奏反応でした。つまり、一段階で起こります。
一方で、SN1反応は求核剤が近づくまえに脱離基が脱離します。その後求核剤の付加が起こるので、二段階反応となります。
この反応の律速段階(一番反応の遅い段階)はハロゲンが脱離する段階です。この段階では、それ自身の分子以外は関わらないので、SN“1”反応と呼ばれるわけです。
反応について
生成物の立体配置について
キラルな(鏡像体が元の化合物と重ならない)アルキルの場合、脱離後の求核剤の付加を見ると、脱離した側とそうではない側からの二通りの付加の仕方が考えられます(下図)。

SN2反応と同じように、脱離基が脱離した方と逆側から付加すると、もとの化合物とは立体配置が反転した化合物が生成します。
一方で、脱離基が脱離した方と同じ側から付加すると、立体配置を保持した化合物が生成します。
その結果、立体配置を保持した化合物と反転した化合物の混合物が得られます。
実際には、脱離基が完全に遊離せずカルボカチオンの近傍に存在しているために、脱離基が脱離する方の逆側からの攻撃が多少多くなり、立体反転した化合物が保持した化合物よりも多く生成します。
ところで、二つの立体異性体が等量得られることを、完全ラセミ化といい、反転した生成物が多く得られることを、部分ラセミ化と呼びます。よって、SN1反応ではふつう、部分ラセミ化が起こると言えます。
反応性について
カルボカチオンの安定性
反応機構を見て分かるように、脱離後にカルボカチオンを生成するので、これが安定であればあるほどSN1反応が進行しやすいと言えます。
カルボカチオンの(相対的)安定性は、
メチルカチオン<第一級<第二級<<第三級
であり、第三級カルボカチオンが圧倒的に安定であるということは覚えてほしいです。これゆえに、SN1反応は第三級ハロゲン化アルキルのときに顕著に現れます。
級数が高いほどカルボカチオンの安定性が上がるのは、超共役のためです。
先ほども、カルボカチオンがsp2混成軌道であると言いましたが、混成に使われないp軌道は空となっています。このp軌道は、正電荷を持つ炭素に結合している原子のσ結合と重なることができ、これにより電荷の分散が可能になります。これが超共役であり、重なることのできるσ結合は、第一級カルボカチオンで3つ、二級で6つ、三級で9つとなるため、級が上がると安定化すると分かります。
脱離基(ハロゲン)による違い
SN2反応と同様に、脱離基が脱離しやすいほど反応性は上がります。
したがって、SN1反応におけるハロゲン化アルキルの(相対的)反応性は
RI > RBr > RCl > RF
となります。
これは、同種の塩基(ハロゲンイオン)において、塩基性が弱いほどその脱離能が高いためです。
詳しくはSN2反応参照
求核剤となるのは
反応機構から分かるように、SN1反応において求核剤は律速段階(脱離する段階)が終わるまでは関与しないので、求核剤の反応性はSN1反応の反応速度に影響及ぼしません。
このため、溶媒が求核剤となるならば、ほとんどのSN1反応は溶媒が求核剤として働きます。こういった、溶媒との反応は加溶媒分解と呼ばれます。
たとえば、臭化tert-ブチル(2-ブロモ-2メチルプロパン)はメタノール(溶媒)中でSN1反応により、メチル-tert-ブチルエーテルが生じます。
反応の利用
求核剤として水が反応すればアルコールが、アルコールが反応すればエーテルが生成します。


まとめ
- SN1反応では、分子中のハロゲンが、ひとりでに脱離してカルボカチオンを生じる!!
- その後は、求核剤がくっついて、同じ求核剤(塩基)がプロトンが引き抜くという流れ
- カルボカチオンは第三級が圧倒的に安定なため、SN1反応は第三級のハロゲン化アルキルでしか起こらない!!
- 立体配置を考える必要があるとき、SN1反応では、D体L体混合物(ラセミ化合物)が得られる




コメント