SN2反応やSN1反応の求核置換反応とは別に、E1反応とE2反応という脱離反応が存在します。
E1反応とE2反応のEとは、Elimination(脱離)を意味し、1や2は求核置換反応同様、それぞれ1分子、2分子を意味します。
ここでは、律速段階に2分子が関係する E2反応を解説します。
反応機構
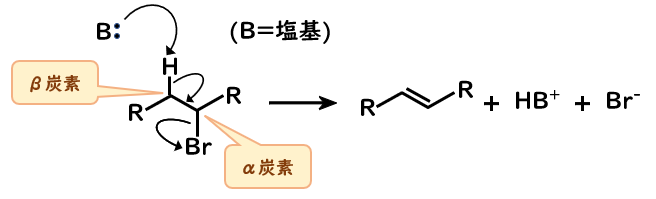
- 塩基が、ハロゲンに結合している炭素(α炭素)に隣接している炭素(β炭素)からプロトン(β水素)を引き抜き、炭素-水素結合の電子がα炭素の方に動く。
それと同時に、ハロゲンが結合電子を持って脱離する。
β炭素において脱プロトン化が起こるので、E2反応はβ脱離反応とも呼ばれます。
また、脱離する原子(ハロゲン)が互いに隣接する炭素上にあるので1,2-脱離反応とも呼ばれます。
反応について
ハロゲン化アルキルによる違い
求核置換反応と同様に、脱離基が脱離しやすいほど反応性は上がります。
したがって、SN1反応におけるハロゲン化アルキルの(相対的)反応性は
RI > RBr > RCl > RF
となります。
これは、同種の塩基(ハロゲンイオン)において、塩基性が弱いほどその脱離能が高いためです。
詳しくはSN2反応参照
位置選択性について
2-ブロモブタンが、メトキシドイオンとE2反応を起こす場合を考えてみましょう。
生成するアルケンとして、2-ブテンと1-ブテンが考えられますね。この場合、どちらが主生成物となるのでしょうか。
その答えは2-ブテンとなります。
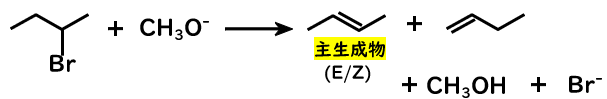
これは、アルケンの安定性は、より多くの置換基を持っていると増すためです。この場合、2-ブテンが置換基が2つ(メチル基×2)なのに対して、1ブテンは置換基が1つ(エチル基)なので、2-ブテンの方がより安定ということになります。
結合している水素が少ない方のβ炭素からプロトンが脱離したときに、より多置換のアルケンが生成するという則は、Zaitsev則と呼ばれます。(高校の化学でも、分子内脱水によるアルケン生成のところでやったかもしれません)
β炭素が二つあるときにはふつう、より多置換のアルケンが主生成物になるということを覚えておけばよいでしょう。
また、生成するアルケンはE体/Z体の混合物となります。
ハロゲン化アルキルの級数による違い
反応物について考えてみると、第二級ハロゲン化アルキルがE2反応を起こすと、第一級ハロゲン化アルキルのE2反応で生成するアルケンよりも、より多置換なアルケン、すなわちより安定なアルケンが生成しうることが分かります。第二級ハロゲン化アルキルに対する第三級ハロゲン化アルキルについても同じことが言えます。
安定なものが生成するということは、反応が進みやすいということですので、E2反応におけるハロゲン化アルキルの相対的反応性は
第三級 > 第二級 > 第一級
となります。
Zaitsev則に従わない場合
前に述べたように、基本的にE2反応ではZaitsev則に従って、より多置換なアルケンが生成します。
しかし、次のようなときには、その限りではありません。
フッ化アルキルのE2反応
フッ化アルキルのE2反応の場合、より不安定なアルケンが生成します。
これの理由を説明するためには、反応の遷移状態を考える必要があります。
ハロゲン化アルキルの相対的反応性で述べたように、ハロゲンイオンの中でフッ素イオンは最も塩基性が強い(共役酸が弱酸)ため、脱離能が低いということになります。
したがって、塩基がβ水素を引き抜く遷移状態において、プロトンの脱離がまあまあ進んでいてもフッ素はそれほど脱離せず、アルケンというよりも、β炭素が負電荷を帯びたカルボアニオンに近い状態となっています。

カルボカチオンの安定性は第三級>第二級>第一級>メチルカチオンの順であり、これはアルキル基が電子供与性のため、簡単に言えば、炭素上の正電荷を軽減できるためでした。
一方でカルボアニオンの場合、負電荷を帯びているために電子供与性のアルキル基がついているほど不安定となります。
したがって、カルボアニオンの安定性は
第三級 < 第二級 < 第一級 < メチルアニオン
となります。
したがって、上の図でいえば左の遷移状態の方が安定となり、その結果、多置換でない方のアルケンが生成します。
多置換でない方がより安定なアルケンの場合
たとえば、多置換でない方のアルケンを生成することで共役二重結合(ジエン)となる場合や、ベンゼン環との共役ができるような場合には、そちらが主生成物となります。
これは、アルケンの置換基をもつことによる安定化よりも、共鳴による安定化のほうが大きいためです。
基本的に、共役系の化合物(二つ以上の多重結合が互いに単結合を挟んで相互作用しているものをもつ化合物)は、とても安定ということを覚えておきましょう。
立体障害が多い場合
2-ブロモ-2-メチルブタンに、tert-ブトキシドイオンが攻撃する場合のE2反応を考えてみましょう。
引き抜かれうるβ水素は3つあり、それぞれが引き抜かれると、1つは安定なアルケンを(点線)、2つは不安定なアルケン(実線)を生成します。
Zaitsev則にのっとって、より多置換で安定なアルケンが生成すると考えたくなりますが、ここで、塩基の立場になり、β水素の引き抜きやすさについて想像してみると、

実線の先にあるβ水素は端にあり障害物がないのに対して、点線の先にあるβ水素は分子の内側にあり、接近しにくそうです。
実際、このために接近のしやすい実線の方の引き抜きが優先されて、主生成物は2-メチル-1-ブテンとなります。
このように、反応物が立体的に混み合っている場合には不安定なアルケンが主生成物となります。
立体的に混み合っているとは、ハロゲン化アルキルと塩基の両方がかさ高いときで、片方だけではZaitsev則に従い、安定なアルケンが生成します。
反応の利用
E2反応はアルケンを得るのに有用な反応です。安定なアルケン、不安定なアルケンのどちらが欲しいのかによって試薬を考えましょう。
収率を上げる工夫として、脱離能の高い脱離基、つまりヨウ素や臭素化アルキルを使うことや、
立体障害が多く、不安定なアルケンが生成する場合には塩基をよりかさ高くすることなどがあります。


まとめ
- 塩基がハロゲン化アルキルのβ水素を引き抜きながら、ハロゲンが徐々に脱離することでアルケンが生成する
- 主生成物のアルケンは普通、より安定な多置換の方であり、結合している水素が少ないβ炭素のプロトンの引き抜きにより起こる
- 立体障害の多いとき、共鳴により安定となるとき、フッ化アルキルを用いたときには多置換でない方のアルケンが生成する




コメント