SN2反応はSubstitution(置換)-Nucleophile(求核)-2(2分子)の略であり、つまり求核置換反応を意味します。有機化学において基礎となる重要な反応ですので、しっかり覚えましょう。
ハロゲン化アルキルのSN2反応
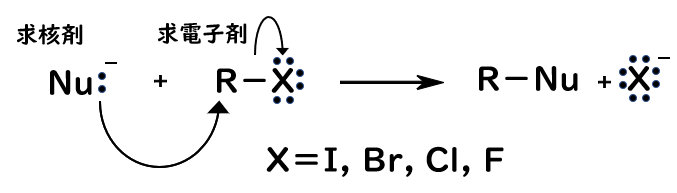
- 求核剤(電子豊富な分子やイオン)が求電子剤のハロゲン化アルキルのハロゲン原子の隣の炭素に対して背面攻撃をすることで、求核剤がアルキル基に付加する。ハロゲン原子(脱離基)は電子を持っていき、ハロゲンイオンを生成する。
反応機構において、電子の移動を表す際には、曲がった矢印を用います。また、2電子の移動には両矢印、1電子移動(ラジカル反応など)の際には片矢印を用います。
この反応の駆動力は、ハロゲンの電気陰性度にあります。電気陰性度の高い、すなわち電子をより強く引き付ける能力のあるハロゲンがあると、その隣の炭素は電子を奪われ気味になって、電子不足な状態(求電子性)となります。そこで、電子豊富な求核剤がその炭素へと電子を提供し、ハロゲンがC-X結合の2電子を持っていく(脱離)ことでこの反応が起こります。
SN2反応の特徴は、求核剤が求電子剤に対して背面攻撃をするという点です。これにより立体配置が反転します。つまり、R体であれば、S体に、S体であればR体となります。立体配置を考慮する必要がある場合には注意しましょう。
求核剤となる化学種
求核剤となるのは電子が豊富な化学種なので、負電荷をもつような化学種、例えば、
OH–, HS–, –NH2, –C≡N, RO–, RS–, RNH–, RC≡C–, RCOO–, Cl–, Br–, I–…
などが挙げられます。これ以外にも、非共有電子対をもつ化学種、
H2O, H2S, NH3, ROH, RSH, RNH2…
なども求核剤になることができます。
電子の豊富さから考えて分かるように、負電荷をもつ化学種のほうが求核性は高いです。
もちろん、求核性の高い求核剤を用いたほうが反応は良く進行します。
また、塩基性が強いほど求核性は高くなります。
反応性について…
脱離基(ハロゲン)による違い
ハロゲン化アルキルの相対的反応性は
RI > RBr > RCl > RF
となります。
これは、同種の塩基において、塩基性が弱いほどその脱離能が高いためです。
その理由については、脱離基の共役酸(HI、HBr、HCl、HF)を考えてみると理解しやすいです。例えば、HClがHFよりも強酸であるということはよく知っていると思います。
そもそも酸とはプロトンの放出しやすさを表すので、HClよりも弱酸のHFはHF分子として多少存在できるとわかります。
すなわち、HFの結合の強さはHClよりも強く、F–がプロトンと電子をうまく共有できる能があることを示しています。
したがって、プロトンをアルキル基と置き換えると、弱塩基(共役酸が強酸)はアルキル基と弱い結合を、強塩基(共役酸が弱酸)はアルキル基と強い結合ができると分かります。
共役酸の強さ HI>HBr>HCl>HFより、 塩基の強さF– > Cl– > Br– > I– であることと先のことを考えれば、R-X結合の強さは、RI < RBr < RCl < RFであり、すなわち脱離能が RI > RBr > RCl > RF であることが導かれます。
立体障害による違い
求電子剤について、SN2反応における相対的反応性は
ハロゲン化メチル>第一級ハロゲン化アルキル>第二級ハロゲン化アルキル>第三級ハロゲン化アルキル
となります。
例)

このように、同じ第一級ハロゲン化アルキルでも、長鎖の方が臭素に結合する炭素について、立体障害が大きいので反応性が落ちます。
また、第三級ハロゲン化アルキルのSN2反応は起こらないと思って頂いて大丈夫です。
求核剤はハロゲンに結合している炭素に対して背面攻撃を仕掛けるので、その炭素に大きいものがついてたり、色々ついてるほど単純に邪魔で仕掛けにくいですよね。こういった立体障害の考え方は、脱保護など色々な反応に関わってくるので、日頃から考えるようにしましょう。
溶媒による影響
求核剤の攻撃する原子が同じくらいの大きさの求核剤どうしの求核性を比較するときは、塩基性を考えればよいですが、大きさがとても異なる場合には溶媒の影響を考慮する必要があります。
ハロゲンイオンは求核剤となりますが、F–, Cl–, Br–, I– の大きさは非常に異なります。これらの求核剤の求核性は、溶媒が非プロトン性溶媒なのか、プロトン性溶媒なのかにより変化します。
非プロトン性溶媒(DMSO:ジメチルスルホキシド, DMF:ジメチルホルムアミド, THF:テトラヒドロフラン, 酢酸エチル, ジエチルエーテル, トルエン, ヘキサン…)では、塩基性が強くなると求核性は高くなります。つまり、求核性は
F– > Cl– > Br– > I–
となります。(塩基性は、脱離基による違いで述べたように F– > Cl– > Br– > I– でしたよね。)
一方で、プロトン性溶媒(水、アルコール、酢酸…)では、塩基性が強くなると求核性は低下し、
F– < Cl– < Br– < I–
となります。
反応の利用
ハロゲン化アルキルは多くの求核剤と反応するため、SN2反応により様々な化合物を合成することができます。例えば、クロロエタンと各種求核剤により、
CH3CH2Cl + OH– → CH3CH2OH + Cl– (アルコール)
CH3CH2Cl + RO– → CH3CH2OR + Cl– (エーテル)
CH3CH2Cl + HS– → CH3CH2SH + Cl– (チオール)
CH3CH2Cl + RS– → CH3CH2SR + Cl– (チオエーテル)
CH3CH2Cl + –NH2 → CH3CH2NH2 + Cl– (一級アミン)
CH3CH2Cl + –C≡N → CH3CH2C≡N + Cl– (ニトリル)
CH3CH2Cl + –C≡CR → CH3CH2C≡CR + Cl– (アルキン)
といった化合物を合成できます。
まとめ
- ハロゲンなどの電子吸引性基のついた炭素に対して求核剤が反応することで、SN2反応により、ハロゲンが求核剤と置き換わり、立体反転した化学種が得られる。
- ハロゲン化アルキルの反応性はRI>RBr>RCl>RFである。(毎回出てきます)
- 攻撃を受ける炭素上の立体障害が大きいほど反応性が下がる。
この記事では、ハロゲン化アルキルを例にSN2反応を解説しましたが、本質は電子不足の炭素に求核剤が攻撃するということです。



コメント